- BOTANISTE JEAN-MARC GIL TOUT SUR LA BOTANIQUE
- LA BOTANIQUE
- GLOSSAIRE BOTANIQUE
- GLOSSAIRE
- DIOXYDE DE CARBONE
DIOXYDE DE CARBONE
Le dioxyde de carbone, aussi appelé gaz carbonique ou anhydride carbonique, est un composé inorganique dont la formule chimique est CO2, la molécule ayant une structure linéaire de la forme O=C=O. Il se présente, sous les conditions normales de température et de pression, comme un gaz incolore, inodore, à la saveur piquante.
Le CO2 est utilisé par l'anabolisme des végétaux pour produire de la biomasse à travers la photosynthèse, processus qui consiste à réduire le dioxyde de carbone par l'eau, grâce à l'énergie lumineuse reçue du Soleil et captée par la chlorophylle, en libérant de l'oxygène pour produire des oses, et en premier lieu du glucose par le cycle de Calvin. Le CO2 est libéré, à travers le cycle de Krebs, par le catabolisme des plantes, des animaux, des fungi (mycètes, ou champignons) et des micro-organismes. Ce catabolisme consiste notamment à oxyder les lipides et les glucides en eau et en dioxyde de carbone grâce à l'oxygène de l'air pour produire de l'énergie et du pouvoir réducteur, sous forme respectivement d'ATP et de NADH + H+. Le CO2 est par conséquent un élément fondamental du cycle du carbone sur notre planète. Il est également produit par la combustion des énergies fossiles telles que le charbon, le gaz naturel et le pétrole, ainsi que par celle de toutes les matières organiques en général. Des quantités significatives de CO2 sont par ailleurs rejetées par les volcans et autres phénomènes géothermiques tels que les geysers.
En septembre 2016 le dioxyde de carbone était présent dans l'atmosphère terrestre à une concentration de 401 ppmv (parties par million en volume), soit 0,0401 %14. En 2009, cette concentration atteignait précisément 386 ppmv, contre seulement 283,4 ppmv en 1839 d'après les carottes de glace prélevées dans la région du cap Poinsett dans l'Antarctique, soit une augmentation globale d'environ 42 % en 177 ans.
Le CO2 est un gaz à effet de serre bien connu, transparent en lumière visible mais absorbant dans le domaine infrarouge, de sorte qu'il tend à bloquer la réémission vers l'espace de l'énergie thermique reçue au sol sous l'effet du rayonnement solaire ; il serait responsable de 26 % de l'effet de serre à l'œuvre dans notre atmosphère (la vapeur d'eau en assurant 60 %), où l'augmentation de sa concentration serait en partie responsable du réchauffement climatique constaté à l'échelle de notre planète depuis les dernières décennies du XXe siècle. Par ailleurs, l'acidification des océans résultant de la dissolution du dioxyde de carbone atmosphérique pourrait compromettre la survie de nombreux organismes marins avant la fin du XXIe siècle, notamment tous ceux à exosquelette calcifié tels que les coraux et les coquillages, mais aussi de certains poissons.
|
Dioxyde de carbone |
|||||||
|
Identification |
|||||||
|
Dioxyde de carbone |
|||||||
|
gaz carbonique |
|||||||
|
ChEBI |
|||||||
|
E290 |
|||||||
|
Apparence |
gaz comprimé liquéfié, incolore, inodore1. |
||||||
|
Propriétés chimiques |
|||||||
|
Propriétés physiques |
|||||||
|
−78,48 °C (sublimation, 760 mmHg) |
|||||||
|
−56,6 °C (5,12 atm) |
|||||||
|
dans l'eau à 20 °C : 88 mL/100 mL sous 1 bar de CO2, soit 1,69 g par kg d'eau (3,35 g à 0 °C ; 0,973 g à 40 °C ; 0,576 g à 60 °C)4 |
|||||||
|
5 720 kPa (20 °C) 569,1 mmHg (−82 °C); |
|||||||
|
0,07 mPa·s à −78 °C |
|||||||
|
31,3 °C ; 72,9 atm; 0,464 g·cm-3 3 |
|||||||
|
−56,6 °C à 5,11 atm 3 |
|||||||
|
3,840×10-5 cal·cm-1·s-1·K-1 à 20 °C |
|||||||
|
259 m·s-1 (0 °C,1 atm) 6 |
|||||||
|
Thermochimie |
|||||||
|
-393,52 kJ·mol-1 7 |
|||||||
|
Propriétés électroniques |
|||||||
|
13,773 ± 0,002 eV (gaz)9 |
|||||||
|
Cristallographie |
|||||||
|
P42/mnm |
|||||||
|
a = 3,535 Å b = 3,535 Å γ = 90,00 ° 10 |
|||||||
|
Volume |
51,73 Å3 10 |
||||||
|
Propriétés optiques |
|||||||
|
n 589 0 {\displaystyle n_{589}^{0}} |
|||||||
|
Précautions |
|||||||
|
H280, P403, P410, |
|||||||
|
|
|||||||
|
|
|||||||
|
Unités du SI et CNTP, sauf indication contraire. |
|||||||
Caractéristiques physico-chimiques
À pression atmosphérique, il se sublime à −78,5 °C11 (passage de l'état solide à l'état gazeux), mais ne fond pas (passage de l'état solide à l'état liquide).
La phase liquide ne peut exister qu'à une pression minimale de 519 kPa (soit 5,12 atm), et dans un intervalle de température allant de −56,6 °C (point triple) à 31,1 °C au maximum à 7,38 MPa (soit 72,8 atm) (point critique).
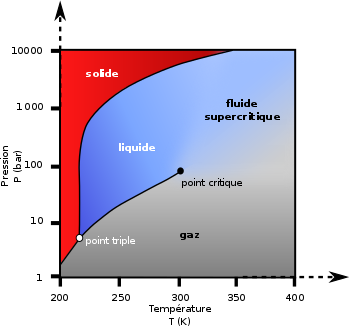
Diagramme de phase pression-température du dioxyde de carbone, montrant le point triple et le point critique.
Pression de vapeur saturante25
|
|

Structure cristalline de la « glace sèche » : cubique à faces centrées.
|
Chaleurs latentes de transition d’état |
||
|
Transition |
Température |
Chaleur latente |
|
Vaporisation |
0 °C |
234,5 kJ.kg−1 |
|
Vaporisation |
−16,7 °C |
276,8 kJ.kg−1 |
|
Vaporisation |
−28,9 °C |
301,7 kJ.kg−1 |
|
Fusion |
−56,6 °C |
199 kJ.kg−1 |
|
Il existerait au moins cinq phases solides moléculaires (existant à « basse » pression, moins de 30 à 60 GPa) et trois phases solides polymériques (aux pressions plus élevées) du CO226 :
|
||
Solubilité aqueuse
Le CO2 se dissout dans l’eau et y forme de l’acide carbonique H2CO3 : CO2 (aq) + H2O(l) ⇌ {\displaystyle \rightleftharpoons }
Il est également liposoluble (soluble dans les corps gras).
L’acide carbonique n’est que modérément stable et il se décompose facilement en H2O et CO2. En revanche, lorsque le dioxyde de carbone se dissout dans une solution aqueuse basique (soude, potasse…), la base déprotone l’acide carbonique pour former un ion hydrogénocarbonate HCO–3, aussi appelé ion bicarbonate, puis un ion carbonate CO2–3. De cette façon, la solubilité du CO2 est considérablement augmentée.
Par exemple, une solution aqueuse saturée de carbonate de potassium K2CO3 a une concentration de 112 % (en masse) en carbonate à 20 °C.
C'est ainsi que le calcaire se dissout dans l'eau, dans la plage de pH dans laquelle l'hydrogénocarbonate acide est stable, en produisant une solution d'hydrogénocarbonate(s) (de calcium et de magnésium…). Il est donc susceptible de précipiter lorsque le CO2 dissous est dégazé, comme dans la formation des stalagmites et des stalactites. Le calcaire a ainsi, en présence de CO2, une solubilité qui diminue quand la température augmente, à l'instar des gaz et au contraire de la plupart des solides (dont la solubilité augmente généralement avec la température).
Dans certaines conditions (haute pression + basse température) le CO2 peut être piégé dans des cages d'eau dites clathrates. C'est un des moyens possibles de séparation industrielle du CO2 contenu dans un gaz30 en pré- ou post-combustion. C'est aussi un des moyens envisagés de séquestration de CO2 industrielle32,33 ou de stockage géologique étudié, éventuellement corrélativement à la dessalinisation d'eau de mer (il peut théoriquement même être substitué au Méthane d'hydrate de méthane).
Évolution temporelle
Le dioxyde de carbone est l'un des premiers gaz (avec la vapeur d'eau) à avoir été décrit comme étant une substance distincte de l'air. Au XVIIe siècle, le chimiste et médecin flamand Jean-Baptiste Van Helmont observa qu'en brûlant du charbon de bois en vase clos, la masse des cendres résultantes est inférieure à celle du charbon. Son interprétation était que la masse manquante s'était transmutée en une substance invisible qu'il nomme « gas » ou spiritus sylvestre (« esprit sauvage »).
Les propriétés du dioxyde de carbone furent étudiées plus en détail dans les années 1750 par le chimiste et physicien écossais Joseph Black. Il découvrit qu'en chauffant ou en versant un acide sur du calcaire (roche composée de carbonate de calcium), il en résultait l'émission d'un gaz, qu'il nomma « air fixe », mettant à mal la théorie du phlogiston encore enseignée à cette époque. Il observa que celui-ci est plus dense que l'air et qu'il ne peut ni entretenir une flamme, ni la vie d'un animal. Black découvrit également que lorsque le dioxyde de carbone est introduit dans une solution calcaire (hydroxyde de calcium), il en résulte un précipité de carbonate de calcium. Il utilisa ce phénomène pour illustrer le fait que le dioxyde de carbone est produit par la respiration animale et la fermentation microbienne.
En 1772, le chimiste anglais Joseph Priestley publia un ouvrage intitulé Impregnating Water with Fixed Air dans lequel il décrivit un processus consistant à verser de l'acide sulfurique (ou « huile de vitriol » comme on la nommait à cette époque) sur de la craie afin de produire du dioxyde de carbone, puis forçant le gaz à se dissoudre dans un bol d'eau. Il venait d'« inventer » l'eau gazeuse. Le procédé est ensuite repris par Johann Jacob Schweppe qui fonda, en 1790, à Londres une usine de production de soda connue sous le nom de Schweppes.
En 1781, le chimiste français Antoine Lavoisier mit en évidence le fait que ce gaz est le produit de la combustion du carbone avec le dioxygène.
Le dioxyde de carbone fut liquéfié pour la première fois en 1823 par Humphry Davy et Michael Faraday40. La première description du dioxyde de carbone en phase solide fut écrite par Charles Thilorier (en), qui en 1834 ouvrit un container pressurisé de gaz carbonique liquéfié et découvrit que le refroidissement produit par la rapide évaporation du liquide générait de la « neige » de CO2.
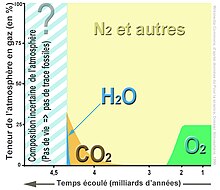
Évolution des teneurs connues de CO2 de l'atmosphère terrestre. Pour rendre ces variations plus visibles, l'échelle temporelle n'est pas linéaire
La teneur en CO2 à mi-hauteur de la troposphère (ici en juillet 2008, environ 8 000 m au-dessus du niveau des mers) est influencée par les émissions au sol et celles des avions, mais subit aussi les grands courants de circulation atmosphérique (source : NASA/Atmospheric Infrared Sounder).
Utilisations
Sous forme gazeuse
Le CO2 a de nombreuses utilisations, dont :
- l’extinction des feux : beaucoup de centres de données (salles de serveurs d’ordinateurs) ou de salles d'archives sont équipés d’un système qui, en cas d’incendie, remplit la salle de CO2 ce qui a pour effet d’éteindre le feu ;
- composant pétillant dans les boissons gazeuses ;
- en aquariophilie et culture sous serre pour une meilleure croissance des plantes ;
- en emballages à atmosphère contrôlée comme élément neutralisant ;
- en distribution d’eau potable, associé au carbonate, pour relever la dureté de l'eau (TH) des eaux trop agressives ;
- solubilisation du calcaire dans les eaux dures (TH > 25 °F) ;
- les pompes à bière : en étant en contact avec la surface de la bière, il évite son oxydation et prolonge sa conservation, contrairement à un compresseur utilisant de l'air (ambiant) ;
- on se sert aussi parfois du CO2 dans les grands abattoirs de porcs afin de les insensibiliser avant de les saigner ; il a été utilisé pour la conservation de la viande ;
- composant nécessaire au phénomène de photosynthèse qui permet aux végétaux de croître en transformant les matières inorganiques en matières organiques constituant ainsi leur bois43.
- fluide caloporteur dans certains types de réacteurs nucléaires tels que ceux de la filière UNGG en France
Sous forme liquide
Sous forme liquide, il est utilisé comme :
- réfrigérant pour congeler certains aliments ;
- réfrigérant dans l’industrie électronique ;
- agent d’extinction dans les extincteurs dits « au dioxyde de carbone », on parle parfois de neige carbonique parce qu'une partie du CO2 liquide se solidifie immédiatement à la sortie de l’extincteur en produisant une poudre blanche en mélange avec du dioxyde de carbone gazeux ;
- agent propulseur (et parfois également carbonatant) pour les boissons servies à la pression.
Quand il est utilisé comme fluide frigorigène, le CO2 porte la dénomination R744. Son utilisation comme fluide frigorigène tend à se démocratiser ces dernières années : il est considéré comme "frigorigène naturel", et son Potentiel de Réchauffement Global est très bas comparé aux fluides frigorigènes "traditionnels".
À pression atmosphérique, le dioxyde de carbone n’est jamais sous forme liquide. Il passe directement de la forme solide à la forme gazeuse (sublimation).
Sous forme solide
Le dioxyde de carbone sous forme solide a de nombreuses appellations : « glace carbonique », « neige carbonique », « Carboglace™ », « glace sèche ». Il est issu de la solidification du CO2 liquide. On obtient de la neige carbonique qui est ensuite comprimée pour obtenir de la glace carbonique.
Dans sa phase solide, cette glace carbonique se sublime en ne laissant aucun résidu, avec une enthalpie de sublimation de 573 kJ·kg- (soit 25,2 kJ·mol-1), à −78,5 °C et à 1 atm. On lui a donc rapidement trouvé de multiples utilisations en tant que réfrigérant.
Il est commercialisé sous différentes présentations selon son usage :
- en granules (de la taille d'un grain de riz de 3 mm de diamètre) : essentiellement pour le nettoyage et le décapage cryogénique ;
- en bâtonnets (d'une longueur d'environ 16 mm) :
- pour la conservation, le transport des produits sous température dirigée (produits pharmaceutiques, transport de surgelés, transport d'échantillons, etc.) ;
- dans l'évènementiel : la glace carbonique dans l'eau forme un brouillard très dense qui glisse le long des parois du contenant ;
- pour la recherche fondamentale ou appliquée, par ex. :
- en chimie, comme réfrigérant en mélange avec un solvant organique (le plus souvent l'acétone) afin de mieux conduire la chaleur, plus rarement comme réactif. Dans ce domaine, on utilise le terme de « Carboglace™ » en France, ou juste "carbo" dans le langage parlé, et jamais le terme « glace sèche » qui est par contre privilégié au Québec.
- pour la vinification : il ralentit la fermentation et évite l'oxydation ;
- en plaquette ou en blocs :
- pour le ravitaillement aérien (catering), les traiteurs, les pompes funèbres, etc.
- en pains :
- pour faire du brouillard épais (effets spéciaux, cinéma, vidéo).
Le dioxyde de carbone solide est également présent sous forme de neige aux pôles de la planète Mars, où il couvre pendant l'hiver local les calottes glaciaires (composées d'eau très majoritairement) et leurs périphéries, ainsi que sous forme de givre carbonique à plus basse latitude, en fin de nuit au début des printemps locaux (photographies prises par les atterrisseurs Viking, le rover Sojourner, l’atterrisseur Phoenix, et de nombreuses images HRSC).

Bâtonnets de glace carbonique se sublimant à l'air.
En phase supercritique
Au-delà de son point critique, le dioxyde de carbone entre dans une phase appelée supercritique. La courbe d'équilibre liquide-gaz est interrompue au niveau du point critique, assurant à la phase supercritique un continuum des propriétés physico-chimiques sans changement de phase. C'est une phase aussi dense qu'un liquide mais assurant des propriétés de transport (viscosité, diffusion) proches de celles d'un gaz. Le dioxyde de carbone supercritique est utilisé comme solvant vert, les extraits étant exempts de trace de solvant.
Sous cette forme, il sert comme :
- agent d'extraction :
- décaféination du café,
- élimination de la 2,4,6-trichloroanisole (TCA) des bouchons de liège traités au chlore (ou à l'hypochlorite) pour éviter de donner un goût bouchonné au vin après sa mise en bouteille,
- extraction de composés chimiques ou biologiques,
- purification de composés chimiques (phase mobile en chromatographie, notamment en SFC) ;
- agent de transport et de stockage lors de la séquestration géologique du dioxyde de carbone (dans de rares applications industrielles) ;
- agent de refroidissement pour permettre la micronisation de principes actifs.
Réactivité
L'électronégativité des atomes d'oxygène rend le carbone central très électrophile. De très nombreux nucléophiles peuvent donc réagir avec le dioxyde de carbone mais le produit de la réaction n'est pas forcément stable. En général, on place de la carboglace dans un récipient fermé muni d'un tuyau ; la carboglace se sublime et on fait buller le dioxyde de carbone gazeux dans le milieu réactionnel.
Quelques exemples de réaction :
- avec une amine : on appelle cette réaction une carbonatation. Le produit est un hydrogénocarbonate d'ammonium (R3N + CO2 + H2O → R3NH+HCO3–) ;
- avec un carbanion : on forme un acide carboxylique après hydrolyse ;
- avec l'eau.
Toxicité
L'air extérieur contient aujourd'hui environ 0,04 % de CO2.
À partir d'une certaine concentration dans l'air, ce gaz s'avère dangereux voire mortel à cause du risque d'asphyxie ou d'acidose, bien que le CO2 ne soit pas chimiquement toxique. La valeur limite d'exposition est de 3 % sur une durée de quinze minutes. Cette valeur ne doit jamais être dépassée. Au-delà, les effets sur la santé sont d'autant plus graves que la teneur en CO2 augmente. Ainsi, à 2 % de CO2 dans l’air, l'amplitude respiratoire augmente. À 4 %, la fréquence respiratoire s'accélère. À 10 %, peuvent apparaître des troubles visuels, des tremblements et des sueurs. À 15 %, c'est la perte de connaissance brutale. À 25 %, un arrêt respiratoire entraîne le décès.
L'inhalation de dioxyde de carbone concentré entraîne un blocage de la ventilation, parfois décrit comme une violente sensation d'étranglement, un souffle coupé, une détresse respiratoire ou encore une oppression thoracique, pouvant rapidement mener au décès si l'exposition est prolongée.
Des études signalent selon l'ANSES « des concentrations associées à des effets sanitaires intrinsèques du CO2 (seuil à environ 10 000 ppm correspondant à l'apparition d'une acidose respiratoire (baisse du pH sanguin), premier effet critique du CO2) ». Une acidose respiratoire peut survenir dès 1 % (10 000 ppm) de CO2 dans l'air, s'il est respiré durant 30 minutes ou plus par un adulte en bonne santé avec une charge physique modérée, et probablement plus tôt chez des individus vulnérables ou sensibles. Ces taux "sont supérieures aux valeurs limites réglementaire et/ou normative de qualité du renouvellement d'air en France et au niveau international, qui varient usuellement entre 1 000 et 1 500 ppm de CO2". Une petite étude expérimentale (ayant concerné 22 adultes a conclu à un effet du CO2 sur la psychomotricité et la fonction intellectuelle (prise de décision, résolution de problèmes) dès de 1 000 ppm (étude Satish et al., 2012), mais cette étude doit être confirmé par des travaux ayant une puissance statistique plus élevée. L'Anses note qu'il y a finalement peu d'études épidémiologiques sur ce polluant commun, dont sur d'éventuels effets CMR (cancérigènes, mutagènes et reprotoxiques).
Le dioxyde de carbone étant un gaz incolore et lourd s'accumulant en nappes, il est difficilement détectable par une personne non expérimentée.
Dans l'air intérieur
Selon l'ANSES, en France, le taux de CO2 dans l'air intérieur des bâtiments (lié à l'occupation humaine ou animale et à la présence d'installations de combustion), pondéré par le renouvellement de l'air, est « habituellement compris entre 350 et 2 500 ppm environ ». D'après les résultats de campagnes de mesures nationales réalisées dans les logements, les écoles, les crèches et les bureaux par l'Observatoire de la qualité de l'air intérieur (Oqai), le ministère chargé de l'Écologie et le CSTB, il n'y a pas de relations systématiques entre les taux de CO2 et d'autres polluants.
Dans les logements
Il n'est pas réglementé dans l'air du domicile ; mais il doit être mesuré en tant qu'indicateur de confinement et de la qualité du renouvellement de l'air dans certains lieux confinés, sur la base de normes dont l'ANSES estime qu'elles n'ont pas de bases sanitaires.
Dans les bâtiments non résidentiels
En France, le règlement sanitaire départemental (RSD) recommande de ne pas passer le seuil de 1 000 ppm (partie par million) "dans des conditions normales d'occupation", avec une tolérance à 1 300 ppm dans les lieux où il est interdit de fumer (« sans fondement sanitaire explicite de ces deux valeurs » selon l'Anses. Un décret du 5 janvier 2012 impose une surveillance de la qualité de l'air intérieur à certains établissements recevant du public sensible tel que les enfants ; il propose le calcul d'un indice de confinement dit "indice Icone" (proposé par le Centre scientifique et technique du bâtiment (CSTB) sur la base de la fréquence de dépassement des niveaux de CO2 par rapport à deux seuils de 1 000 et 1 700 ppm dans les salles de classe.
En milieu professionnel, la question de la sécurité et de la prévention liée aux risques d'intoxication au dioxyde de carbone est une préoccupation majeure pour limiter les risques d'accident du travail. Faute de données épidémiologiques, il n'a cependant pas été considéré comme pertinent en France comme indicateur de la qualité sanitaire de l'air intérieur par l'Anses qui ne prévoit pas de valeur guide de qualité d'air intérieur (VGAI) pour ce polluant.
Dans de fortes concentrations approchant les 50 à 100 %, telles que celles retrouvées dans les nappes de dioxyde de carbone d'origine artificielle en milieu professionnel, il peut se produire un effet de sidération nerveuse et une perte de conscience immédiate, suivie d'une mort rapide en l'absence d'aide extérieure. Ces accidents présentent un risque élevé de suraccident, des témoins pouvant se précipiter au secours de la victime sans penser à leur propre sécurité et devenir eux aussi victimes de l'intoxication.

Augmentation annuelle de CO2. En quarante ans, de 1960 à l'an 2000 (un peu plus d'une génération humaine), le taux moyen annuel de CO2 a augmenté de 37 % (NOAA)

Évolution sur 57 ans du taux de CO2 mesuré dans l'air à l'observatoire de Mauna Loa.
La figure en encart détaille la chute saisonnière du CO2 durant la saison de végétation (d'avril à octobre) et son élévation en automne/hiver de l'hémisphère nord (la végétation terrestre est plus importante dans l'hémisphère nord).

Comparaison des courbes de température, CO2 et d'activité solaire.
La part anthropique du réchauffement semble augmenter depuis la révolution industrielle.
Légende et sources :
* Bleu clair : CO2 d'après les carottes de glace polaire, NOAA/ Law Dome
* Bleu : CO2 à Mauna Loa, NOAA/Mauna Loa
* Rouge : température (°C), Unité de recherche climatique (Univ. East Anglia)
* Orange : taches solaires, Solar Influences Data Analysis Center (SIDC)
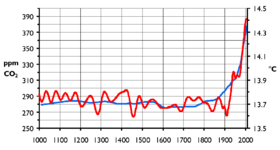
Première courbe de reconstitution sur 1 000 ans des températures passées à partir des carottes de glaces polaires. Cette courbe, reprise par le GIEC a été contestée par les climato-sceptiques jugeant qu'elle sous-estimait les taux de CO2 des années 1920 ou antérieures, ou que les bulles piégées dans la glace ne sont pas assez représentatives des teneurs passées en gaz de l'air. D'autres travaux plus récents ont confirmé un profil de ce type . La rapidité d'augmentation du CO2 depuis la révolution industrielle n'est pas contestée, et semble sans commune mesure avec ce qui est rétrospectivement observées pour les derniers millénaires (ici depuis la fin de la dernière glaciation).
Le dioxyde de carbone n'est normalement présent dans l'atmosphère terrestre qu'à l'état de traces. Il est mesuré via un indice, nommé "Annual Greenhouse Gas Index" (AGGI) depuis 1979 par un réseau d'une centaine de stations sur terre et en mer, disposées de l'Arctique au pôle Sud.
Depuis la révolution industrielle, en raison de la combustion constante de très grandes quantité de carbone fossile, alors que la régression des incendies, des forêts et des superficies végétalisées se poursuit, le taux de CO2 dans l'air augmente régulièrement (actuellement : 405 parties par million (ppm) en volume.50 Ceci correspond à une masse totale de CO2 atmosphérique d'environ 3,16×1015 kg (environ 3 000 gigatonnes). L'année 1990 (qui correspond à un surplus d'environ 2,1 watts/m² par rapport à 1980) est l'année de référence retenue pour le protocole de Kyoto (elle a donc un « indice AGGI » de 1)51,52. Un groupe de recherche spécifique sur le cycle du carbone et les gaz a effet de serre a été mis en place
À un instant « t », la teneur en CO2 diffère dans chaque hémisphère, avec dans chaque hémisphère des variations saisonnière régulières (cf motif « en dents de scie » sur le graphique de droite, montrant une baisse du CO2 en saison de végétation et une augmentation en hiver). Il existe aussi des variations régionales en particulier au niveau de la couche limite atmosphérique, c'est-à-dire dans les couches proches du sol.
Les taux de CO2 sont généralement plus élevés dans les zones urbaines et dans les habitations (jusqu'à 10 fois le niveau de fond).
Peu après la formation de la terre (bien avant l'apparition de la vie), alors que le soleil était presque deux fois moins « chaud », la pression initiale de CO2 était environ 100 000 fois plus élevée qu'aujourd’hui (30 à 60 atmosphères de CO2 (soit 3 000 000 à 6 000 000 pascals), soit 100 000 fois la quantité actuelle de CO2 il y a environ 4,5 milliards d'années).
Puis la vie et la photosynthèse sont apparues, prélevant le CO2 de l'atmosphère et de l'eau pour le transformer en roches carbonatées et en charbon, pétrole et gaz naturel, en grande partie enfouis dans les profondeurs de la terre54. Le taux de CO2 a néanmoins encore connu quelques pics de bien moindre importance (20 fois plus élevée qu'aujourd'hui il y a environ un demi milliard d'années, mais le soleil était alors moins chaud qu'aujourd'hui (le rayonnement solaire croît avec le temps ; il a augmenté d'environ 40 % dans les 4 derniers milliards d'années). Le taux de CO2 a encore chuté de 4-5 fois durant le Jurassique, puis a diminué lentement, sauf, de manière accélérée durant un épisode géologiquement bref, dit « évènement Azolla » (il y a environ 49 millions d'années).
Le volcanisme émet aussi du CO2 (jusqu'à 40 % des gaz émis par certains volcans lors des éruptions subaériennes sont du dioxyde de carbone) et certaines sources chaudes en émettent aussi (par exemple sur le site italien de Bossoleto près de Rapolano Terme où dans une dépression en forme de cuvette d'environ 100 m de diamètre, par nuit calme, le taux de CO2 peut grimper de 75 % en quelques heures, assez pour tuer les insectes et petits animaux. Mais la masse de gaz se réchauffe rapidement quand le site est ensoleillé et est alors dispersée par les courants de convection de l'air durant la journée 58. Localement des concentrations élevées de CO2, produites par la perturbation de l'eau d'un lac profond saturé en CO2 peuvent aussi tuer (exemple : 37 morts lors d'une éruption de CO2 à partir du lac Monoun au Cameroun en 1984 et 1700 victimes autour du lac Nyos (Cameroun également) en 1986.
Les émissions de CO2 par les activités humaines sont actuellement plus de 130 fois supérieures à la quantité émise par les volcans, d'un montant de près de 27 milliards de tonnes par an en 2007. En 2012, la Chine est le premier émetteur mondial de dioxyde de carbone avec 27 % du total, et les États-Unis, en deuxième position, produit 14 % du total mondial.
Nutrition végétale
Le principal élément nutritif intervenant dans la nutrition végétale est le carbone, tiré du dioxyde de carbone de l'air par les plantes autotrophes grâce au processus de la photosynthèse. Des apports de CO2 sont effectués dans les cultures sous serres afin d'accélérer la croissance des végétaux. On recommande en général un taux moyen de 1 000 ppm.
Gaz à effet de serre et acidifiant
Le CO2 serait le deuxième gaz à effet de serre le plus important dans l'atmosphère après la vapeur d'eau, contribuant respectivement à hauteur de 26 % et 60 % à ce phénomène. La réalité du réchauffement climatique observé à l'échelle planétaire depuis le siècle dernier n'est aujourd'hui plus guère contestée d'un point de vue scientifique62, mais la part exacte de responsabilité du dioxyde de carbone dans ce processus (par rapport au méthane notamment) doit encore être précisée, grâce aux enregistrements fossiles des paléoclimats notamment.
Une réduction des émissions anthropiques est visée par le protocole de Kyōto ainsi que par la directive 2003/87/CE ; sa séquestration géologique à long terme fait l'objet de recherches mais est une solution controversée quand il s'agit simplement d'injecter du CO2 dans les couches géologiques.
Effets écosystémiques de l'augmentation du taux de CO2 dans l'eau et dans l'air
Dans l'eau
Le CO2 a un certain effet eutrophisant (c'est un nutriment de base, essentiel pour les plantes), mais il est aussi un facteur d'acidification des océans et de certaines masses d'eau douce, qui peut négativement interférer avec de nombreuses espèces (dont certaines microalgues et autres microorganismes aquatiques protégées par des structures calcaires que l'acide carbonique peut dissoudre). L'acidification favorise aussi la libération et la circulation et donc la biodisponibilité de la plupart des métaux lourds, métalloïdes ou radionucléides (naturellement présent dans les sédiments ou d'origine anthropique depuis la révolution industrielle surtout).
Dans l'air
L'augmentation de la teneur de l'atmosphère en CO2 peut aussi avoir des effets différentiés voire antagonistes selon son taux, le contexte environnemental et biogéographique et selon des données plus récentes selon la saison et les variations saisonnières de la pluviométrie (au-dessus des forêts notamment) ;
Il existe chez les écologues associés à l'étude des effets du changement climatique un consensus sur le fait qu'au-delà d'une augmentation de 2 °C en un siècle, les écosystèmes terrestres et marins seront sérieusement négativement affectés.
En 2013, la réponse réelle des écosystèmes au CO2 et ses modulations biogéographiques sont encore considérées comme complexes et à mieux comprendre, en raison de nombreux « feedbacks biogéochimiques ». Elle doit être néanmoins élucidée si l'on veut correctement évaluer voire prédire les capacités planétaires ou locales des écosystèmes en termes de stockage naturel du carbone et d'amortissement des effets du dérèglement climatique induit par l'Homme.
Les rétroactions médié par le cycle hydrologique sont particulièrement importantes et la pluviométrie y joue un rôle majeur. La physiologie des plantes a au moins un rôle bien connu ; jusqu'à un certain stade (au-delà duquel la plante dépérit), l'augmentation du taux de CO2 de l'air réduit la conductance stomatique et augmente les besoins en eau de la plante (la quantité d'eau nécessaire pour produire une unité de matière sèche). Il a été estimé (en 2008) que les effets de l'augmentation du CO2 dans l'air sur l'écosystème devrait donc être exacerbés quand l'eau est un facteur limitant 71 (mais les apports d'azote sont aussi à prendre en compte) ; ceci a été démontré par quelques expériences74, mais est un facteur qui a été "oublié" par de nombreuses études.
Cette relation semble si forte qu'elle permet - en zone tempérée de prédire avec précision les variations annuelles de la stimulation de la biomasse aérienne à la suite de l'élévation du taux de CO2 dans une prairie mixte contenant des végétaux de type C3 et C4, sur la base du total des précipitations saisonnières ; les pluies d'été ayant un effet positif, alors que celles d'automne et du printemps ont des effets négatifs sur la réponse au CO2. L'effet du taux croissant de CO2 dépendra donc principalement des nouveaux équilibres ou déséquilibres qui s'établiront entre les précipitations estivales et d'automne / printemps.
Le lien à l'azote (autre élément perturbé par les activités humaines dont par l'agriculture industrielle, l'industrie et les émissions de la circulation automobile) est ici retrouvé : c'est en partie car les fortes précipitations en saisons froides et humides conduisent à limiter l'accès des plantes terrestres à l'azote qu'elles réduisent ou interdisent la stimulation de la biomasse par un taux de CO2 élevé. Il a aussi été noté que cette prédiction valait aussi pour des parcelles « réchauffées » de 2 °C ou non-réchauffées, et était similaire pour les plantes en C3 et de la biomasse totale, ce qui semble permettre aux prospectivistes de faire des prévisions robustes sur les réponses aux concentrations élevées de CO2 de l'écosystème. Ceci est un atout précieux car les projections climatiques des modèles à haute résolution confirment la très forte probabilité de changements importants dans la répartition annuelle des pluies, même là où la quantité annuelle totale de pluie tombée au sol ne changera pas. Ces données scientifiquement confirmées (en 2013) devraient aider à expliquer certaines différences apparues dans les résultats des expériences basées sur l'exposition de plantes à un taux accru de CO2, et améliorer l'efficacité prospective des modèles qui ne tenaient pas assez compte des effets saisonniers des précipitations sur les réponses de la biodiversité au CO2 14,
dont en milieux forestiers.
Enfin, les effets de l'augmentation du CO2 sur les plantes se montrent plus préoccupants que ce qui était prédit par les premiers modèles des années 1990 et du début des années 200082. Morgan et al. sur la base d'expériences de laboratoire et in situ, ont confirmé dès 2004 que dans les écosystèmes émergés, le CO2, même quand il améliore la productivité en termes de biomasse, peut néanmoins avoir des effets négatifs en modifiant la composition des espèces et en réduisant la digestibilité des graminées courtes par exemple dans la végétation steppique)
Réduction du CO2 dans l'atmosphère
Plusieurs voies sont explorées ou déjà mises en œuvre pour limiter l'accumulation du CO2 dans l'atmosphère. Elles peuvent faire appel à des processus naturels comme la photosynthèse ou à des procédés industriels. Il faut également distinguer la capture à la source de la capture dans l'atmosphère.
DIOXYDE DE CARBONE
Le dioxyde de carbone, aussi appelé gaz carbonique ou anhydride carbonique, est un composé inorganique dont la formule chimique est CO2, la molécule ayant une structure linéaire de la forme O=C=O. Il se présente, sous les conditions normales de température et de pression, comme un gaz incolore, inodore, à la saveur piquante.
Le CO2 est utilisé par l'anabolisme des végétaux pour produire de la biomasse à travers la photosynthèse, processus qui consiste à réduire le dioxyde de carbone par l'eau, grâce à l'énergie lumineuse reçue du Soleil et captée par la chlorophylle, en libérant de l'oxygène pour produire des oses, et en premier lieu du glucose par le cycle de Calvin. Le CO2 est libéré, à travers le cycle de Krebs, par le catabolisme des plantes, des animaux, des fungi (mycètes, ou champignons) et des micro-organismes. Ce catabolisme consiste notamment à oxyder les lipides et les glucides en eau et en dioxyde de carbone grâce à l'oxygène de l'air pour produire de l'énergie et du pouvoir réducteur, sous forme respectivement d'ATP et de NADH + H+. Le CO2 est par conséquent un élément fondamental du cycle du carbone sur notre planète. Il est également produit par la combustion des énergies fossiles telles que le charbon, le gaz naturel et le pétrole, ainsi que par celle de toutes les matières organiques en général. Des quantités significatives de CO2 sont par ailleurs rejetées par les volcans et autres phénomènes géothermiques tels que les geysers.
En septembre 2016 le dioxyde de carbone était présent dans l'atmosphère terrestre à une concentration de 401 ppmv (parties par million en volume), soit 0,0401 %14. En 2009, cette concentration atteignait précisément 386 ppmv, contre seulement 283,4 ppmv en 1839 d'après les carottes de glace prélevées dans la région du cap Poinsett dans l'Antarctique, soit une augmentation globale d'environ 42 % en 177 ans.
Le CO2 est un gaz à effet de serre bien connu, transparent en lumière visible mais absorbant dans le domaine infrarouge, de sorte qu'il tend à bloquer la réémission vers l'espace de l'énergie thermique reçue au sol sous l'effet du rayonnement solaire ; il serait responsable de 26 % de l'effet de serre à l'œuvre dans notre atmosphère (la vapeur d'eau en assurant 60 %), où l'augmentation de sa concentration serait en partie responsable du réchauffement climatique constaté à l'échelle de notre planète depuis les dernières décennies du XXe siècle. Par ailleurs, l'acidification des océans résultant de la dissolution du dioxyde de carbone atmosphérique pourrait compromettre la survie de nombreux organismes marins avant la fin du XXIe siècle, notamment tous ceux à exosquelette calcifié tels que les coraux et les coquillages, mais aussi de certains poissons.
|
Dioxyde de carbone |
|||||||
|
Identification |
|||||||
|
Dioxyde de carbone |
|||||||
|
gaz carbonique |
|||||||
|
ChEBI |
|||||||
|
E290 |
|||||||
|
Apparence |
gaz comprimé liquéfié, incolore, inodore1. |
||||||
|
Propriétés chimiques |
|||||||
|
Propriétés physiques |
|||||||
|
−78,48 °C (sublimation, 760 mmHg) |
|||||||
|
−56,6 °C (5,12 atm) |
|||||||
|
dans l'eau à 20 °C : 88 mL/100 mL sous 1 bar de CO2, soit 1,69 g par kg d'eau (3,35 g à 0 °C ; 0,973 g à 40 °C ; 0,576 g à 60 °C)4 |
|||||||
|
5 720 kPa (20 °C) 569,1 mmHg (−82 °C); |
|||||||
|
0,07 mPa·s à −78 °C |
|||||||
|
31,3 °C ; 72,9 atm; 0,464 g·cm-3 3 |
|||||||
|
−56,6 °C à 5,11 atm 3 |
|||||||
|
3,840×10-5 cal·cm-1·s-1·K-1 à 20 °C |
|||||||
|
259 m·s-1 (0 °C,1 atm) 6 |
|||||||
|
Thermochimie |
|||||||
|
-393,52 kJ·mol-1 7 |
|||||||
|
Propriétés électroniques |
|||||||
|
13,773 ± 0,002 eV (gaz)9 |
|||||||
|
Cristallographie |
|||||||
|
P42/mnm |
|||||||
|
a = 3,535 Å b = 3,535 Å γ = 90,00 ° 10 |
|||||||
|
Volume |
51,73 Å3 10 |
||||||
|
Propriétés optiques |
|||||||
|
n 589 0 {\displaystyle n_{589}^{0}} |
|||||||
|
Précautions |
|||||||
|
H280, P403, P410, |
|||||||
|
|
|||||||
|
|
|||||||
|
Unités du SI et CNTP, sauf indication contraire. |
|||||||
Caractéristiques physico-chimiques
À pression atmosphérique, il se sublime à −78,5 °C11 (passage de l'état solide à l'état gazeux), mais ne fond pas (passage de l'état solide à l'état liquide).
La phase liquide ne peut exister qu'à une pression minimale de 519 kPa (soit 5,12 atm), et dans un intervalle de température allant de −56,6 °C (point triple) à 31,1 °C au maximum à 7,38 MPa (soit 72,8 atm) (point critique).

Diagramme de phase pression-température du dioxyde de carbone, montrant le point triple et le point critique.
Pression de vapeur saturante25
|
|

Structure cristalline de la « glace sèche » : cubique à faces centrées.
|
Chaleurs latentes de transition d’état |
||
|
Transition |
Température |
Chaleur latente |
|
Vaporisation |
0 °C |
234,5 kJ.kg−1 |
|
Vaporisation |
−16,7 °C |
276,8 kJ.kg−1 |
|
Vaporisation |
−28,9 °C |
301,7 kJ.kg−1 |
|
Fusion |
−56,6 °C |
199 kJ.kg−1 |
|
Il existerait au moins cinq phases solides moléculaires (existant à « basse » pression, moins de 30 à 60 GPa) et trois phases solides polymériques (aux pressions plus élevées) du CO226 :
|
||
Solubilité aqueuse
Le CO2 se dissout dans l’eau et y forme de l’acide carbonique H2CO3 : CO2 (aq) + H2O(l) ⇌ {\displaystyle \rightleftharpoons }
Il est également liposoluble (soluble dans les corps gras).
L’acide carbonique n’est que modérément stable et il se décompose facilement en H2O et CO2. En revanche, lorsque le dioxyde de carbone se dissout dans une solution aqueuse basique (soude, potasse…), la base déprotone l’acide carbonique pour former un ion hydrogénocarbonate HCO–3, aussi appelé ion bicarbonate, puis un ion carbonate CO2–3. De cette façon, la solubilité du CO2 est considérablement augmentée.
Par exemple, une solution aqueuse saturée de carbonate de potassium K2CO3 a une concentration de 112 % (en masse) en carbonate à 20 °C.
C'est ainsi que le calcaire se dissout dans l'eau, dans la plage de pH dans laquelle l'hydrogénocarbonate acide est stable, en produisant une solution d'hydrogénocarbonate(s) (de calcium et de magnésium…). Il est donc susceptible de précipiter lorsque le CO2 dissous est dégazé, comme dans la formation des stalagmites et des stalactites. Le calcaire a ainsi, en présence de CO2, une solubilité qui diminue quand la température augmente, à l'instar des gaz et au contraire de la plupart des solides (dont la solubilité augmente généralement avec la température).
Dans certaines conditions (haute pression + basse température) le CO2 peut être piégé dans des cages d'eau dites clathrates. C'est un des moyens possibles de séparation industrielle du CO2 contenu dans un gaz30 en pré- ou post-combustion. C'est aussi un des moyens envisagés de séquestration de CO2 industrielle32,33 ou de stockage géologique étudié, éventuellement corrélativement à la dessalinisation d'eau de mer (il peut théoriquement même être substitué au Méthane d'hydrate de méthane).
Évolution temporelle
Le dioxyde de carbone est l'un des premiers gaz (avec la vapeur d'eau) à avoir été décrit comme étant une substance distincte de l'air. Au XVIIe siècle, le chimiste et médecin flamand Jean-Baptiste Van Helmont observa qu'en brûlant du charbon de bois en vase clos, la masse des cendres résultantes est inférieure à celle du charbon. Son interprétation était que la masse manquante s'était transmutée en une substance invisible qu'il nomme « gas » ou spiritus sylvestre (« esprit sauvage »).
Les propriétés du dioxyde de carbone furent étudiées plus en détail dans les années 1750 par le chimiste et physicien écossais Joseph Black. Il découvrit qu'en chauffant ou en versant un acide sur du calcaire (roche composée de carbonate de calcium), il en résultait l'émission d'un gaz, qu'il nomma « air fixe », mettant à mal la théorie du phlogiston encore enseignée à cette époque. Il observa que celui-ci est plus dense que l'air et qu'il ne peut ni entretenir une flamme, ni la vie d'un animal. Black découvrit également que lorsque le dioxyde de carbone est introduit dans une solution calcaire (hydroxyde de calcium), il en résulte un précipité de carbonate de calcium. Il utilisa ce phénomène pour illustrer le fait que le dioxyde de carbone est produit par la respiration animale et la fermentation microbienne.
En 1772, le chimiste anglais Joseph Priestley publia un ouvrage intitulé Impregnating Water with Fixed Air dans lequel il décrivit un processus consistant à verser de l'acide sulfurique (ou « huile de vitriol » comme on la nommait à cette époque) sur de la craie afin de produire du dioxyde de carbone, puis forçant le gaz à se dissoudre dans un bol d'eau. Il venait d'« inventer » l'eau gazeuse. Le procédé est ensuite repris par Johann Jacob Schweppe qui fonda, en 1790, à Londres une usine de production de soda connue sous le nom de Schweppes.
En 1781, le chimiste français Antoine Lavoisier mit en évidence le fait que ce gaz est le produit de la combustion du carbone avec le dioxygène.
Le dioxyde de carbone fut liquéfié pour la première fois en 1823 par Humphry Davy et Michael Faraday40. La première description du dioxyde de carbone en phase solide fut écrite par Charles Thilorier (en), qui en 1834 ouvrit un container pressurisé de gaz carbonique liquéfié et découvrit que le refroidissement produit par la rapide évaporation du liquide générait de la « neige » de CO2.

Évolution des teneurs connues de CO2 de l'atmosphère terrestre. Pour rendre ces variations plus visibles, l'échelle temporelle n'est pas linéaire
La teneur en CO2 à mi-hauteur de la troposphère (ici en juillet 2008, environ 8 000 m au-dessus du niveau des mers) est influencée par les émissions au sol et celles des avions, mais subit aussi les grands courants de circulation atmosphérique (source : NASA/Atmospheric Infrared Sounder).
Utilisations
Sous forme gazeuse
Le CO2 a de nombreuses utilisations, dont :
- l’extinction des feux : beaucoup de centres de données (salles de serveurs d’ordinateurs) ou de salles d'archives sont équipés d’un système qui, en cas d’incendie, remplit la salle de CO2 ce qui a pour effet d’éteindre le feu ;
- composant pétillant dans les boissons gazeuses ;
- en aquariophilie et culture sous serre pour une meilleure croissance des plantes ;
- en emballages à atmosphère contrôlée comme élément neutralisant ;
- en distribution d’eau potable, associé au carbonate, pour relever la dureté de l'eau (TH) des eaux trop agressives ;
- solubilisation du calcaire dans les eaux dures (TH > 25 °F) ;
- les pompes à bière : en étant en contact avec la surface de la bière, il évite son oxydation et prolonge sa conservation, contrairement à un compresseur utilisant de l'air (ambiant) ;
- on se sert aussi parfois du CO2 dans les grands abattoirs de porcs afin de les insensibiliser avant de les saigner ; il a été utilisé pour la conservation de la viande ;
- composant nécessaire au phénomène de photosynthèse qui permet aux végétaux de croître en transformant les matières inorganiques en matières organiques constituant ainsi leur bois43.
- fluide caloporteur dans certains types de réacteurs nucléaires tels que ceux de la filière UNGG en France
Sous forme liquide
Sous forme liquide, il est utilisé comme :
- réfrigérant pour congeler certains aliments ;
- réfrigérant dans l’industrie électronique ;
- agent d’extinction dans les extincteurs dits « au dioxyde de carbone », on parle parfois de neige carbonique parce qu'une partie du CO2 liquide se solidifie immédiatement à la sortie de l’extincteur en produisant une poudre blanche en mélange avec du dioxyde de carbone gazeux ;
- agent propulseur (et parfois également carbonatant) pour les boissons servies à la pression.
Quand il est utilisé comme fluide frigorigène, le CO2 porte la dénomination R744. Son utilisation comme fluide frigorigène tend à se démocratiser ces dernières années : il est considéré comme "frigorigène naturel", et son Potentiel de Réchauffement Global est très bas comparé aux fluides frigorigènes "traditionnels".
À pression atmosphérique, le dioxyde de carbone n’est jamais sous forme liquide. Il passe directement de la forme solide à la forme gazeuse (sublimation).
Sous forme solide
Le dioxyde de carbone sous forme solide a de nombreuses appellations : « glace carbonique », « neige carbonique », « Carboglace™ », « glace sèche ». Il est issu de la solidification du CO2 liquide. On obtient de la neige carbonique qui est ensuite comprimée pour obtenir de la glace carbonique.
Dans sa phase solide, cette glace carbonique se sublime en ne laissant aucun résidu, avec une enthalpie de sublimation de 573 kJ·kg- (soit 25,2 kJ·mol-1), à −78,5 °C et à 1 atm. On lui a donc rapidement trouvé de multiples utilisations en tant que réfrigérant.
Il est commercialisé sous différentes présentations selon son usage :
- en granules (de la taille d'un grain de riz de 3 mm de diamètre) : essentiellement pour le nettoyage et le décapage cryogénique ;
- en bâtonnets (d'une longueur d'environ 16 mm) :
- pour la conservation, le transport des produits sous température dirigée (produits pharmaceutiques, transport de surgelés, transport d'échantillons, etc.) ;
- dans l'évènementiel : la glace carbonique dans l'eau forme un brouillard très dense qui glisse le long des parois du contenant ;
- pour la recherche fondamentale ou appliquée, par ex. :
- en chimie, comme réfrigérant en mélange avec un solvant organique (le plus souvent l'acétone) afin de mieux conduire la chaleur, plus rarement comme réactif. Dans ce domaine, on utilise le terme de « Carboglace™ » en France, ou juste "carbo" dans le langage parlé, et jamais le terme « glace sèche » qui est par contre privilégié au Québec.
- pour la vinification : il ralentit la fermentation et évite l'oxydation ;
- en plaquette ou en blocs :
- pour le ravitaillement aérien (catering), les traiteurs, les pompes funèbres, etc.
- en pains :
- pour faire du brouillard épais (effets spéciaux, cinéma, vidéo).
Le dioxyde de carbone solide est également présent sous forme de neige aux pôles de la planète Mars, où il couvre pendant l'hiver local les calottes glaciaires (composées d'eau très majoritairement) et leurs périphéries, ainsi que sous forme de givre carbonique à plus basse latitude, en fin de nuit au début des printemps locaux (photographies prises par les atterrisseurs Viking, le rover Sojourner, l’atterrisseur Phoenix, et de nombreuses images HRSC).

Bâtonnets de glace carbonique se sublimant à l'air.
En phase supercritique
Au-delà de son point critique, le dioxyde de carbone entre dans une phase appelée supercritique. La courbe d'équilibre liquide-gaz est interrompue au niveau du point critique, assurant à la phase supercritique un continuum des propriétés physico-chimiques sans changement de phase. C'est une phase aussi dense qu'un liquide mais assurant des propriétés de transport (viscosité, diffusion) proches de celles d'un gaz. Le dioxyde de carbone supercritique est utilisé comme solvant vert, les extraits étant exempts de trace de solvant.
Sous cette forme, il sert comme :
- agent d'extraction :
- décaféination du café,
- élimination de la 2,4,6-trichloroanisole (TCA) des bouchons de liège traités au chlore (ou à l'hypochlorite) pour éviter de donner un goût bouchonné au vin après sa mise en bouteille,
- extraction de composés chimiques ou biologiques,
- purification de composés chimiques (phase mobile en chromatographie, notamment en SFC) ;
- agent de transport et de stockage lors de la séquestration géologique du dioxyde de carbone (dans de rares applications industrielles) ;
- agent de refroidissement pour permettre la micronisation de principes actifs.
Réactivité
L'électronégativité des atomes d'oxygène rend le carbone central très électrophile. De très nombreux nucléophiles peuvent donc réagir avec le dioxyde de carbone mais le produit de la réaction n'est pas forcément stable. En général, on place de la carboglace dans un récipient fermé muni d'un tuyau ; la carboglace se sublime et on fait buller le dioxyde de carbone gazeux dans le milieu réactionnel.
Quelques exemples de réaction :
- avec une amine : on appelle cette réaction une carbonatation. Le produit est un hydrogénocarbonate d'ammonium (R3N + CO2 + H2O → R3NH+HCO3–) ;
- avec un carbanion : on forme un acide carboxylique après hydrolyse ;
- avec l'eau.
Toxicité
L'air extérieur contient aujourd'hui environ 0,04 % de CO2.
À partir d'une certaine concentration dans l'air, ce gaz s'avère dangereux voire mortel à cause du risque d'asphyxie ou d'acidose, bien que le CO2 ne soit pas chimiquement toxique. La valeur limite d'exposition est de 3 % sur une durée de quinze minutes. Cette valeur ne doit jamais être dépassée. Au-delà, les effets sur la santé sont d'autant plus graves que la teneur en CO2 augmente. Ainsi, à 2 % de CO2 dans l’air, l'amplitude respiratoire augmente. À 4 %, la fréquence respiratoire s'accélère. À 10 %, peuvent apparaître des troubles visuels, des tremblements et des sueurs. À 15 %, c'est la perte de connaissance brutale. À 25 %, un arrêt respiratoire entraîne le décès.
L'inhalation de dioxyde de carbone concentré entraîne un blocage de la ventilation, parfois décrit comme une violente sensation d'étranglement, un souffle coupé, une détresse respiratoire ou encore une oppression thoracique, pouvant rapidement mener au décès si l'exposition est prolongée.
Des études signalent selon l'ANSES « des concentrations associées à des effets sanitaires intrinsèques du CO2 (seuil à environ 10 000 ppm correspondant à l'apparition d'une acidose respiratoire (baisse du pH sanguin), premier effet critique du CO2) ». Une acidose respiratoire peut survenir dès 1 % (10 000 ppm) de CO2 dans l'air, s'il est respiré durant 30 minutes ou plus par un adulte en bonne santé avec une charge physique modérée, et probablement plus tôt chez des individus vulnérables ou sensibles. Ces taux "sont supérieures aux valeurs limites réglementaire et/ou normative de qualité du renouvellement d'air en France et au niveau international, qui varient usuellement entre 1 000 et 1 500 ppm de CO2". Une petite étude expérimentale (ayant concerné 22 adultes a conclu à un effet du CO2 sur la psychomotricité et la fonction intellectuelle (prise de décision, résolution de problèmes) dès de 1 000 ppm (étude Satish et al., 2012), mais cette étude doit être confirmé par des travaux ayant une puissance statistique plus élevée. L'Anses note qu'il y a finalement peu d'études épidémiologiques sur ce polluant commun, dont sur d'éventuels effets CMR (cancérigènes, mutagènes et reprotoxiques).
Le dioxyde de carbone étant un gaz incolore et lourd s'accumulant en nappes, il est difficilement détectable par une personne non expérimentée.
Dans l'air intérieur
Selon l'ANSES, en France, le taux de CO2 dans l'air intérieur des bâtiments (lié à l'occupation humaine ou animale et à la présence d'installations de combustion), pondéré par le renouvellement de l'air, est « habituellement compris entre 350 et 2 500 ppm environ ». D'après les résultats de campagnes de mesures nationales réalisées dans les logements, les écoles, les crèches et les bureaux par l'Observatoire de la qualité de l'air intérieur (Oqai), le ministère chargé de l'Écologie et le CSTB, il n'y a pas de relations systématiques entre les taux de CO2 et d'autres polluants.
Dans les logements
Il n'est pas réglementé dans l'air du domicile ; mais il doit être mesuré en tant qu'indicateur de confinement et de la qualité du renouvellement de l'air dans certains lieux confinés, sur la base de normes dont l'ANSES estime qu'elles n'ont pas de bases sanitaires.
Dans les bâtiments non résidentiels
En France, le règlement sanitaire départemental (RSD) recommande de ne pas passer le seuil de 1 000 ppm (partie par million) "dans des conditions normales d'occupation", avec une tolérance à 1 300 ppm dans les lieux où il est interdit de fumer (« sans fondement sanitaire explicite de ces deux valeurs » selon l'Anses. Un décret du 5 janvier 2012 impose une surveillance de la qualité de l'air intérieur à certains établissements recevant du public sensible tel que les enfants ; il propose le calcul d'un indice de confinement dit "indice Icone" (proposé par le Centre scientifique et technique du bâtiment (CSTB) sur la base de la fréquence de dépassement des niveaux de CO2 par rapport à deux seuils de 1 000 et 1 700 ppm dans les salles de classe.
En milieu professionnel, la question de la sécurité et de la prévention liée aux risques d'intoxication au dioxyde de carbone est une préoccupation majeure pour limiter les risques d'accident du travail. Faute de données épidémiologiques, il n'a cependant pas été considéré comme pertinent en France comme indicateur de la qualité sanitaire de l'air intérieur par l'Anses qui ne prévoit pas de valeur guide de qualité d'air intérieur (VGAI) pour ce polluant.
Dans de fortes concentrations approchant les 50 à 100 %, telles que celles retrouvées dans les nappes de dioxyde de carbone d'origine artificielle en milieu professionnel, il peut se produire un effet de sidération nerveuse et une perte de conscience immédiate, suivie d'une mort rapide en l'absence d'aide extérieure. Ces accidents présentent un risque élevé de suraccident, des témoins pouvant se précipiter au secours de la victime sans penser à leur propre sécurité et devenir eux aussi victimes de l'intoxication.

Augmentation annuelle de CO2. En quarante ans, de 1960 à l'an 2000 (un peu plus d'une génération humaine), le taux moyen annuel de CO2 a augmenté de 37 % (NOAA)

Évolution sur 57 ans du taux de CO2 mesuré dans l'air à l'observatoire de Mauna Loa.
La figure en encart détaille la chute saisonnière du CO2 durant la saison de végétation (d'avril à octobre) et son élévation en automne/hiver de l'hémisphère nord (la végétation terrestre est plus importante dans l'hémisphère nord).

Comparaison des courbes de température, CO2 et d'activité solaire.
La part anthropique du réchauffement semble augmenter depuis la révolution industrielle.
Légende et sources :
* Bleu clair : CO2 d'après les carottes de glace polaire, NOAA/ Law Dome
* Bleu : CO2 à Mauna Loa, NOAA/Mauna Loa
* Rouge : température (°C), Unité de recherche climatique (Univ. East Anglia)
* Orange : taches solaires, Solar Influences Data Analysis Center (SIDC)

Première courbe de reconstitution sur 1 000 ans des températures passées à partir des carottes de glaces polaires. Cette courbe, reprise par le GIEC a été contestée par les climato-sceptiques jugeant qu'elle sous-estimait les taux de CO2 des années 1920 ou antérieures, ou que les bulles piégées dans la glace ne sont pas assez représentatives des teneurs passées en gaz de l'air. D'autres travaux plus récents ont confirmé un profil de ce type . La rapidité d'augmentation du CO2 depuis la révolution industrielle n'est pas contestée, et semble sans commune mesure avec ce qui est rétrospectivement observées pour les derniers millénaires (ici depuis la fin de la dernière glaciation).
Le dioxyde de carbone n'est normalement présent dans l'atmosphère terrestre qu'à l'état de traces. Il est mesuré via un indice, nommé "Annual Greenhouse Gas Index" (AGGI) depuis 1979 par un réseau d'une centaine de stations sur terre et en mer, disposées de l'Arctique au pôle Sud.
Depuis la révolution industrielle, en raison de la combustion constante de très grandes quantité de carbone fossile, alors que la régression des incendies, des forêts et des superficies végétalisées se poursuit, le taux de CO2 dans l'air augmente régulièrement (actuellement : 405 parties par million (ppm) en volume.50 Ceci correspond à une masse totale de CO2 atmosphérique d'environ 3,16×1015 kg (environ 3 000 gigatonnes). L'année 1990 (qui correspond à un surplus d'environ 2,1 watts/m² par rapport à 1980) est l'année de référence retenue pour le protocole de Kyoto (elle a donc un « indice AGGI » de 1)51,52. Un groupe de recherche spécifique sur le cycle du carbone et les gaz a effet de serre a été mis en place
À un instant « t », la teneur en CO2 diffère dans chaque hémisphère, avec dans chaque hémisphère des variations saisonnière régulières (cf motif « en dents de scie » sur le graphique de droite, montrant une baisse du CO2 en saison de végétation et une augmentation en hiver). Il existe aussi des variations régionales en particulier au niveau de la couche limite atmosphérique, c'est-à-dire dans les couches proches du sol.
Les taux de CO2 sont généralement plus élevés dans les zones urbaines et dans les habitations (jusqu'à 10 fois le niveau de fond).
Peu après la formation de la terre (bien avant l'apparition de la vie), alors que le soleil était presque deux fois moins « chaud », la pression initiale de CO2 était environ 100 000 fois plus élevée qu'aujourd’hui (30 à 60 atmosphères de CO2 (soit 3 000 000 à 6 000 000 pascals), soit 100 000 fois la quantité actuelle de CO2 il y a environ 4,5 milliards d'années).
Puis la vie et la photosynthèse sont apparues, prélevant le CO2 de l'atmosphère et de l'eau pour le transformer en roches carbonatées et en charbon, pétrole et gaz naturel, en grande partie enfouis dans les profondeurs de la terre54. Le taux de CO2 a néanmoins encore connu quelques pics de bien moindre importance (20 fois plus élevée qu'aujourd'hui il y a environ un demi milliard d'années, mais le soleil était alors moins chaud qu'aujourd'hui (le rayonnement solaire croît avec le temps ; il a augmenté d'environ 40 % dans les 4 derniers milliards d'années). Le taux de CO2 a encore chuté de 4-5 fois durant le Jurassique, puis a diminué lentement, sauf, de manière accélérée durant un épisode géologiquement bref, dit « évènement Azolla » (il y a environ 49 millions d'années).
Le volcanisme émet aussi du CO2 (jusqu'à 40 % des gaz émis par certains volcans lors des éruptions subaériennes sont du dioxyde de carbone) et certaines sources chaudes en émettent aussi (par exemple sur le site italien de Bossoleto près de Rapolano Terme où dans une dépression en forme de cuvette d'environ 100 m de diamètre, par nuit calme, le taux de CO2 peut grimper de 75 % en quelques heures, assez pour tuer les insectes et petits animaux. Mais la masse de gaz se réchauffe rapidement quand le site est ensoleillé et est alors dispersée par les courants de convection de l'air durant la journée 58. Localement des concentrations élevées de CO2, produites par la perturbation de l'eau d'un lac profond saturé en CO2 peuvent aussi tuer (exemple : 37 morts lors d'une éruption de CO2 à partir du lac Monoun au Cameroun en 1984 et 1700 victimes autour du lac Nyos (Cameroun également) en 1986.
Les émissions de CO2 par les activités humaines sont actuellement plus de 130 fois supérieures à la quantité émise par les volcans, d'un montant de près de 27 milliards de tonnes par an en 2007. En 2012, la Chine est le premier émetteur mondial de dioxyde de carbone avec 27 % du total, et les États-Unis, en deuxième position, produit 14 % du total mondial.
Nutrition végétale
Le principal élément nutritif intervenant dans la nutrition végétale est le carbone, tiré du dioxyde de carbone de l'air par les plantes autotrophes grâce au processus de la photosynthèse. Des apports de CO2 sont effectués dans les cultures sous serres afin d'accélérer la croissance des végétaux. On recommande en général un taux moyen de 1 000 ppm.
Gaz à effet de serre et acidifiant
Le CO2 serait le deuxième gaz à effet de serre le plus important dans l'atmosphère après la vapeur d'eau, contribuant respectivement à hauteur de 26 % et 60 % à ce phénomène. La réalité du réchauffement climatique observé à l'échelle planétaire depuis le siècle dernier n'est aujourd'hui plus guère contestée d'un point de vue scientifique62, mais la part exacte de responsabilité du dioxyde de carbone dans ce processus (par rapport au méthane notamment) doit encore être précisée, grâce aux enregistrements fossiles des paléoclimats notamment.
Une réduction des émissions anthropiques est visée par le protocole de Kyōto ainsi que par la directive 2003/87/CE ; sa séquestration géologique à long terme fait l'objet de recherches mais est une solution controversée quand il s'agit simplement d'injecter du CO2 dans les couches géologiques.
Effets écosystémiques de l'augmentation du taux de CO2 dans l'eau et dans l'air
Dans l'eau
Le CO2 a un certain effet eutrophisant (c'est un nutriment de base, essentiel pour les plantes), mais il est aussi un facteur d'acidification des océans et de certaines masses d'eau douce, qui peut négativement interférer avec de nombreuses espèces (dont certaines microalgues et autres microorganismes aquatiques protégées par des structures calcaires que l'acide carbonique peut dissoudre). L'acidification favorise aussi la libération et la circulation et donc la biodisponibilité de la plupart des métaux lourds, métalloïdes ou radionucléides (naturellement présent dans les sédiments ou d'origine anthropique depuis la révolution industrielle surtout).
Dans l'air
L'augmentation de la teneur de l'atmosphère en CO2 peut aussi avoir des effets différentiés voire antagonistes selon son taux, le contexte environnemental et biogéographique et selon des données plus récentes selon la saison et les variations saisonnières de la pluviométrie (au-dessus des forêts notamment) ;
Il existe chez les écologues associés à l'étude des effets du changement climatique un consensus sur le fait qu'au-delà d'une augmentation de 2 °C en un siècle, les écosystèmes terrestres et marins seront sérieusement négativement affectés.
En 2013, la réponse réelle des écosystèmes au CO2 et ses modulations biogéographiques sont encore considérées comme complexes et à mieux comprendre, en raison de nombreux « feedbacks biogéochimiques ». Elle doit être néanmoins élucidée si l'on veut correctement évaluer voire prédire les capacités planétaires ou locales des écosystèmes en termes de stockage naturel du carbone et d'amortissement des effets du dérèglement climatique induit par l'Homme.
Les rétroactions médié par le cycle hydrologique sont particulièrement importantes et la pluviométrie y joue un rôle majeur. La physiologie des plantes a au moins un rôle bien connu ; jusqu'à un certain stade (au-delà duquel la plante dépérit), l'augmentation du taux de CO2 de l'air réduit la conductance stomatique et augmente les besoins en eau de la plante (la quantité d'eau nécessaire pour produire une unité de matière sèche). Il a été estimé (en 2008) que les effets de l'augmentation du CO2 dans l'air sur l'écosystème devrait donc être exacerbés quand l'eau est un facteur limitant 71 (mais les apports d'azote sont aussi à prendre en compte) ; ceci a été démontré par quelques expériences74, mais est un facteur qui a été "oublié" par de nombreuses études.
Cette relation semble si forte qu'elle permet - en zone tempérée de prédire avec précision les variations annuelles de la stimulation de la biomasse aérienne à la suite de l'élévation du taux de CO2 dans une prairie mixte contenant des végétaux de type C3 et C4, sur la base du total des précipitations saisonnières ; les pluies d'été ayant un effet positif, alors que celles d'automne et du printemps ont des effets négatifs sur la réponse au CO2. L'effet du taux croissant de CO2 dépendra donc principalement des nouveaux équilibres ou déséquilibres qui s'établiront entre les précipitations estivales et d'automne / printemps.
Le lien à l'azote (autre élément perturbé par les activités humaines dont par l'agriculture industrielle, l'industrie et les émissions de la circulation automobile) est ici retrouvé : c'est en partie car les fortes précipitations en saisons froides et humides conduisent à limiter l'accès des plantes terrestres à l'azote qu'elles réduisent ou interdisent la stimulation de la biomasse par un taux de CO2 élevé. Il a aussi été noté que cette prédiction valait aussi pour des parcelles « réchauffées » de 2 °C ou non-réchauffées, et était similaire pour les plantes en C3 et de la biomasse totale, ce qui semble permettre aux prospectivistes de faire des prévisions robustes sur les réponses aux concentrations élevées de CO2 de l'écosystème. Ceci est un atout précieux car les projections climatiques des modèles à haute résolution confirment la très forte probabilité de changements importants dans la répartition annuelle des pluies, même là où la quantité annuelle totale de pluie tombée au sol ne changera pas. Ces données scientifiquement confirmées (en 2013) devraient aider à expliquer certaines différences apparues dans les résultats des expériences basées sur l'exposition de plantes à un taux accru de CO2, et améliorer l'efficacité prospective des modèles qui ne tenaient pas assez compte des effets saisonniers des précipitations sur les réponses de la biodiversité au CO2 14,
dont en milieux forestiers.
Enfin, les effets de l'augmentation du CO2 sur les plantes se montrent plus préoccupants que ce qui était prédit par les premiers modèles des années 1990 et du début des années 200082. Morgan et al. sur la base d'expériences de laboratoire et in situ, ont confirmé dès 2004 que dans les écosystèmes émergés, le CO2, même quand il améliore la productivité en termes de biomasse, peut néanmoins avoir des effets négatifs en modifiant la composition des espèces et en réduisant la digestibilité des graminées courtes par exemple dans la végétation steppique)
Réduction du CO2 dans l'atmosphère
Plusieurs voies sont explorées ou déjà mises en œuvre pour limiter l'accumulation du CO2 dans l'atmosphère. Elles peuvent faire appel à des processus naturels comme la photosynthèse ou à des procédés industriels. Il faut également distinguer la capture à la source de la capture dans l'atmosphère.
Ajouter un commentaire

